ข้อสอบ Pat
1)ข้อใดเป็นธาตุ d-block ทั้งหมด
ก.Na, K, Mg, Ca
ข.Cr, Mn, Fe, Co
ค.O, S, F, Cl
ง.La, Ac, U, Pu
2)ข้อใดที่อิเล็กตรอนมีพลังงานมากที่สุด
ก.1s
ข.2s
ค.2p
ง.3p
3)
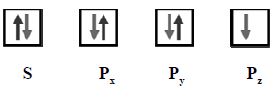
ธาตุใดมีการจัดเรียงอิเล็กตรอนในออร์บิทัลเป็นดังนี้
ก.คาร์บอน
ข.ไนโตรเจน
ค.ออกซิเจน
ง.ฟลูออรีน
4)ข้อใดมีจำนวนอิเล็กตรอนไม่เท่ากัน
ก

ข

ค

ง

5)ธาตุ A เกิดเป็น A+ ไอออน, A และ A+ มีอะไรเหมือนกัน (I) สมบัติทางเคมี (II) สมบัติทางกายภาพ (III) จำนวนโปรตอน
ก.(I) เท่านั้น
ข.(III) เท่านั้น
ค.(I) และ (II) เท่านั้น
ง.(I), (II) และ (III)
6)มวลอะตอมของโบรมีนเป็น 80 ประกอบด้วย 2 ไอโซโทปที่มีสัดส่วนเท่ากัน ถ้าเลขอะตอมของโบรมีนเท่ากับ 35 จำนวนนิวตรอนของแต่ละไอโซโทปเป็นเท่าใด
ก.จำนวนนิวตรอนของไอโซโทป 1 = 34 จำนวนนิวตรอนของไอโซโทป 2 = 36
ข.จำนวนนิวตรอนของไอโซโทป 1 = 45 จำนวนนิวตรอนของไอโซโทป 2 = 45
ค.จำนวนนิวตรอนของไอโซโทป 1 = 44 จำนวนนิวตรอนของไอโซโทป 2 = 46
ง.จำนวนนิวตรอนของไอโซโทป 1 = 45 จำนวนนิวตรอนของไอโซโทป 2 = 46
7)ธาตุ A เกิดซัลเฟต มีสูตร A2(SO4)3 ถ้า A หนัก 9 กรัม รวมพอดีกับออกซิเจนหนัก 32 กรัม มวลอะตอมของA มีค่าเท่าใด (มวลอะตอมของ O = 16, S = 32)
ก.18
ข.27
ค.36
ง.54
8)ข้อใดที่อะตอมของไนโตรเจนมีเลขออกซิเดชันเท่ากัน
ก

ข

ค

ง

9)

ธาตุใดที่มีการเปลี่ยนแปลงเลขออกซิเดชัน
ก.Cr และ Cl
ข.Cl และ I
ค.Cr , Cl และ I
ง.Cr , Cl และ O
10)HCl เตรียมจากปฏิกิริยาระหว่าง H2SO4 เข้มข้นกับของแข็ง NaCl ดังสมการ H2SO4 (l) + NaCl (s) --> HCl (g) + NaHSO4 (s) จะเกิดแก๊ส HCl กี่ cm3 ที่ STP ถ้า H2SO4 มากเกิน ทำปฏิกิริยากับ NaCl หนัก 2 กรัม (มวลอะตอมของ H = 1, O = 16, Na = 23, S = 32, Cl = 35.5)
ก.2.00 x 22400 cm3
ข.2.00 x 58.5 cm3
ค.(2.00 x 22400)/58.5 cm3
ง.(2.00 x 22400 x 760)/(58.5 x 273) cm3
11)ถ้านำแก๊ส HCl ปริมาตร 112 cm3 ที่ STP ละลายน้ำ 25 cm3 จะต้องใช้สารละลาย 0.1 M NaOH สะเทินพอดี จำนวนกี่ cm3
ก.5 cm3
ข.25 cm3
ค.50 cm3
ง.112 cm3
12)Potassium hydrogen phthalate สูตรคือ KH(C8H4O4) ใช้เป็นสารมาตรฐานปฐม ทำการไทเทรตกับสารละลาย KOH ซึ่งมวลโมลาร์ของ KH(C8H4O4) เท่ากับ 204.22 g.(mol^-1) ซึ่งสารละลายมาตรฐานนี้เตรียมโดยสารละลาย KH(C8H4O4) หนัก 5.00 กรัมในน้ำ 250 cm3 จากนั้นนำสารละลายมา 25 cm3 ไทเทรตกับสารละลาย KOH เข้มข้น X mol.(dm^-3) โดยใช้ฟีนอล์ฟทาลีนเป็นอินดิเคเตอร์ที่จุดสะเทินใช้สารละลาย KOH จำนวน 20 cm3 จงหาค่า X เป็นสมการการไทเทรตเป็นดังนี้ KH(C8H4O4)(aq) + KOH (aq) → K2(C8H4O4)(aq) + H2O(l)
ก

ข

ค

ง

13)
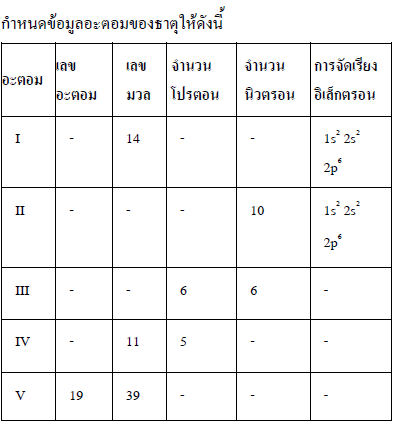
อะตอมใดเป็นไอโซโทปกับ I
ก.II
ข.III
ค.IV
ง.V
14)

ธาตุ A ควรเป็นธาตุใด
ก.ไนโตรเจน
ข.ออกซิเจน
ค.คลอรีน
ง.ฟอสฟอรัส
15)แก๊ส X หนัก 0.22 กรัม บรรจุอยู่ในปริมาตร 484 cm3 ถ้า CO2 หนัก 0.13 กรัม บรรจุอยู่ในปริมาตร 416 cm3 ภายใต้อุณหภูมิและความดันเดียวกัน ข้อใดเป็นมวลโมเลกุลของ X (มวลอะตอมของ C = 12, O = 16)
ก

ข ค
ค
 ค
ค
ง

16)แก๊ส 0.1 ลิตรที่อุณหภูมิ 273 K และความดัน 10^5 kPa ค่าคงที่สากลของแก๊ส (R) เท่ากับ 8.31 J.K^-1.mol^-1 ถ้าอุณหภูมิเปลี่ยนเป็น 546 K ค่า R ควรเป็นตามข้อใด
ก.0.0821 J.K^-1.mol^-1
ข.16.62 J.K^-1.mol^-1
ค.8.31 J.K^-1.mol^-1
ง.4.16 J.K^-1.mol^-1
17)กำหนดปฏิกิริยาให้ดังนี้ BaO(s) + H2SO4(aq) → BaSO4(s) + H2O(l) MgO(s) + H2SO4(aq) → MgSO4(s) + H2O(l) กรดซัลฟิวริกมากเกินพอทำปฏิกิริยากับ 0.75 กรัม ของของผสม BaO และ MgO ได้เกลือ BaSO4 ไม่ละลายน้ำ แต่ MgSO4 ละลายน้ำได้ นำตะกอนที่ได้มาทำให้แห้งชั่ง ได้หนัก 0.42 กรัม ร้อยละของ Mg ในของผสมเป็นเท่าใด (มวลอะตอมของ Ba = 137, S = 32, O = 16, Mg = 24)
ก.30
ข.37
ค.45
ง.55
18)


ภายใต้เงื่อนไขในข้อใดที่จะทำให้เกิดผลิตภัณฑ์ SO3 มากที่สุด
ก.อุณหภูมิต่ำ, ความดันสูง และอากาศมากเกินพอ
ข.อุณหภูมิสูง, ความดันสูง และความเข้มข้นของซัลเฟอร์ไดออกไซด์ต่ำ
ค.อุณหภูมิต่ำ, ความดันต่ำ และซัลเฟอร์ไดออกไซด์มากเกินพอ
ง.อุณหภูมิสูง, ความดันต่ำ และอากาศมากเกินพอ
ดูวิธีทำข้อสอบ Pat2 เคมี(2552) กดตรงนี้
เฉลย
เฉลย
1.ก 2.ง 3.ง 4.ข 5.ข 6ค. 7.ข 8.ค 9.ค 10.ค 11.ค 12.ก 13.ข 14.ง 15.ก 16.ค 17.ข 18.ก 19.ก
ที่มา:trueplookpanya.com


ไม่มีความคิดเห็น:
แสดงความคิดเห็น