ข้อสอบ O-net
1)ธาตุ “E” ทำปฏิกิริยากับออกซิเจนเกิดออกไซด์มีสูตรเป็น E2O3 ซึ่งทำปฏิกิริยา
ได้ทั้งกรดและเบส ธาตุ “E” ควรเป็นข้อใด
ก.Mg
ข.Al
ค.Si
ง.P
2)ข้อใดมีจำนวนอิเล็กตรอนมากที่สุด
ก.
ก.
ข.
ค.
ง.
3)

สารใดเกิดปฏิกิริยารีดักชัน
ก.

ก.

ข.Ag+
ค.
ค.

ง.Ag
4)สารละลายโพแทสเซียมไนเตรทเข้มข้น 0.100 โมลต่อลิตร จำนวน 1.00 ลิตร ผสมกับสารละลายแคลเซียมไนเตรทเข้มข้น 0.100 โมลต่อลิตร จำนวน 1.00 ลิตร ความเข้มข้นของไนเตรท ไอออนในสารละลายหลังผสมเป็นกี่โมลต่อลิตร
ก.0.0500 mol L-1
ข.0.100 mol L-1
ค.0.150 mol L-1
ง.0.200 mol L-1
5)แก๊สคลอรีนตัวอย่างหนัก 71.0 กรัม ข้อใดถูกต้อง (มวลอะตอมของ Cl = 35.5)
ก.24.5 ลิตรที่ 273 K และ 101.3 kPa
ข.6.02 x 1023 อะตอมของคลอรีน
ค.2 โมลของอะตอมคลอรีน
ง.2 โมลของโมเลกุลคลอรีน
6)สังกะสีหนัก 5.0 กรัม ทำปฏิกิริยากับสารละลายกรดไฮโดรคลอริกเข้มข้น 1.00 โมลต่อลิตร จำนวน 20 cm3 จนกระทั่งไม่มีปฏิกิริยาเกิดขึ้น จะเหลือสังกะสีที่ไม่ได้ทำปฏิกิริยากี่กรัม (มวลอะตอมของ Zn = 65)
ก.0.00 g
ข.0.65 g
ค.3.70 g
ง.4.35 g
7)

ก.

ข.

ค.

ง.

8)จำนวนคลอไรด์ไอออนใน 0.25 โมลของแคลเซียมคลอไรด์เป็นเท่าใด
ก.0.50
ข.0.25
ค.3.01 x 1023
ง.1.51 x 1023
9)คู่ใดแทนอันยรูป (allotropes) ของธาตุ
ก.14C และ 12C
ข.1 – เฮปทานอล และ 2-เฮปทานอล
ค.Fe2+ และ Fe3+
ง.O2 และ O3
10)เตรียมสารละลายโซเดียมคลอไรด์ดังนี้
นำโซเดียมคลอไรด์ 5.85 กรัมละลายในน้ำแล้วทำให้มีปริมาตรเป็น 250 ลูกบาศก์เซนติเมตร สารละลายโซเดียมคลอไรด์นี้มีความเข้มข้นกี่โมลต่อลิตร (มวลอะตอมของ Na = 23, CI = 35.5)
นำโซเดียมคลอไรด์ 5.85 กรัมละลายในน้ำแล้วทำให้มีปริมาตรเป็น 250 ลูกบาศก์เซนติเมตร สารละลายโซเดียมคลอไรด์นี้มีความเข้มข้นกี่โมลต่อลิตร (มวลอะตอมของ Na = 23, CI = 35.5)
ก.
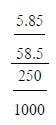
ข.

ค.

ง.

11)เมื่อเติมโลหะทองแดงลงในสารละลายกรดซัลฟิวริก สมการใดถูกต้อง
ก.Cu + H2SO4 → CuSO4 + SO2 + H2O
ข.Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
ค.Cu + 2H2SO4 → Cu(SO4)2 + SO2 + 2H2O
ง.2Cu + H2SO4 → Cu2SO4 + SO2 + H2O
12)ค่าความร้อนของการสันดาปคาร์บอนวัดได้ 32800 Jg-1 ค่าในหน่วย kJ mol-1 จะมีค่าใกล้เคียงกับข้อใด (มวลอะตอมของ C =12)
ก.394000
ข.394
ค.32.8
ง.2.73
13)สารละลายชนิดหนึ่งมี pH = 3.0 สารละลายนี้มีความเข้มข้นของไฮดรอกไซด์ไอออนกี่โมลต่อลิตร
ก.3.0 mol L-1
ข.1.0 x 10-3 mol L-1
ค.1.0 x 10-11 mol L-1
ง.3.0 x 10-14 mol L-1
14)สูบแก๊สไนโตรเจนปริมาณ 1000 กรัมเข้าไปในถังขนาด 50.0 ลิตร ที่อุณหภูมิ 65°C ความดันของแก๊สไนโตรเจนในถังเป็นกี่กิโลปาสคัล (kPa)
ก.35.69 kPa
ข.1408.6 kPa
ค.2000 kPa
ง.2005.9 kPa
15)
15)

ก.+968 kJ
ข.-968 kJ
ค.+1050 kJ
ง.-1050 kJ
16)
16)

ก.+124 kJ
ข.– 124 kJ
ค.2702 kJ
ง.2826 kJ
17)ใช้ข้อมูลต่อไปนี้ตอบคำถามข้อ 17-19  ชื่อของกระบวนการ Y คืออะไร
ชื่อของกระบวนการ Y คืออะไร
 ชื่อของกระบวนการ Y คืออะไร
ชื่อของกระบวนการ Y คืออะไร
ก.การระเหิด
ข.สัมพรรคภาพอิเล็กตรอน
ค.พลังงานและแลตทิซ
ง.พลังงานไอออนไนเซซัน
18)ใช้ข้อมูลต่อไปนี้ตอบคำถามข้อ 17-19  สมการใดแสดงพลังงานการเกิด CaCl2 (s) ที่ถูกต้อง
สมการใดแสดงพลังงานการเกิด CaCl2 (s) ที่ถูกต้อง
 สมการใดแสดงพลังงานการเกิด CaCl2 (s) ที่ถูกต้อง
สมการใดแสดงพลังงานการเกิด CaCl2 (s) ที่ถูกต้อง
ก.Ca(g) + ½Cl2(g) → CaCl(s) ΔH = -798 kJ
ข.Ca(s) + Cl2(g) → CaCl2(s) ΔH = -2249 kJ
ค.Ca(s) + Cl2(g) → CaCl2(s) ΔH = -798 kJ
ง.Ca2+(g) + 2Cl-(g) → CaCl2(s) ΔH = -2249 kJ
19)ใช้ข้อมูลต่อไปนี้ตอบคำถามข้อ 17-19 จงใช้กฎของเฮสส์ (Hess’s law) คำนวณหา DH ของกระบวนการ X ในหน่วย kJ mol-1
จงใช้กฎของเฮสส์ (Hess’s law) คำนวณหา DH ของกระบวนการ X ในหน่วย kJ mol-1
19)ใช้ข้อมูลต่อไปนี้ตอบคำถามข้อ 17-19
 จงใช้กฎของเฮสส์ (Hess’s law) คำนวณหา DH ของกระบวนการ X ในหน่วย kJ mol-1
จงใช้กฎของเฮสส์ (Hess’s law) คำนวณหา DH ของกระบวนการ X ในหน่วย kJ mol-1
ก.-726 kJ mol-1
ข.-726 kJ mol-1
ค.+ 726 kJ mol-1
ง.+242 kJ mol-1
20)ค่าคงที่การละลายของเกลือเงินสองชนิดเป็นดังนี้
ซิลเวอร์คลอไรด์ (AgCl) Ksp = 2.0 × 10-10
ซิลเวอร์คาร์บอเนต (Ag2CO3) Ksp = 8.0 × 10-12
การละลายของเกลือเงินในหน่วยโมลต่อลิตรข้อใดถูก
ซิลเวอร์คลอไรด์ (AgCl) Ksp = 2.0 × 10-10
ซิลเวอร์คาร์บอเนต (Ag2CO3) Ksp = 8.0 × 10-12
การละลายของเกลือเงินในหน่วยโมลต่อลิตรข้อใดถูก
ก.AgCl ละลายได้มากกว่า Ag2CO3
ข.Ag2CO3 ละลายได้มากกว่า AgCl
ค.AgCl ละลายได้เท่ากับ Ag2CO3
ง.AgCl และ Ag2CO3 ไม่ละลายน้ำ จึงคำนวณไม่ได้
21)ข้อมูลจากโจทย์ ข้อ 20 ในสารละลายโซเดียมคลอไรด์ เข้มข้น 0.10 โมลต่อลิตร จะละลาย AgCl ได้กี่โมลต่อลิตร
ก.2 x 10-10 mol dm-3
ข.2 x 10-9 mol dm-3
ค.1.4x 10-5 mol dm-3
เฉลย
1.ข 2.ข 3.ข 4.ค 5.ค 6.ง 7.ก 8.ค 9.ง 10.ก 11.ข 12.ข 13.ค 14.ง 15.ง 16.ข 17.ก 18.ค 19.ข 20.ข 21.ข
ที่มา:trueplookpanya.com

ไม่มีความคิดเห็น:
แสดงความคิดเห็น